
超分辨荧光显微技术
研究亚细胞尺度的精细生物结构和功能的动态变化过程对了解细胞命运决定机制、揭示生命现象本质以及探索重大疾病机理等有着至关重要的意义。近年来,受激发射损耗显微术[1](stimulated emission depletion,STED)、结构光照明显微术[2](structured illumination microscopy,SIM)、单分子定位显微术[3,4](photoactivated localization microscopy/stochastic optical reconstruction microscopy,PALM/STORM)等超分辨成像技术绕开了百余年来似乎一直被认为是无法突破的阿贝衍射极限,在纳米尺度至单分子水平可视化生物分子,以前所未有的时空分辨率探究活细胞结构和动态过程,成为生命科学研究中不可或缺的重要工具。2014 年,诺贝尔化学奖授予 Eric Betzig,Stefan W. Hell 和 William E. Moerner 三位科学家,以表彰他们对超分辨荧光显微成像技术的重大贡献,再一次展现了该技术在人类发展历程中以及未来发展方向上的重要地位[5]。

图1:2014 年,诺贝尔化学奖授予 Eric Betzig,Stefan W. Hell 和 William E. Moerner 三位科学家,以表彰他们对超分辨率荧光显微成像技术的重大贡献
在众多超分辨成像技术中,SIM 利用强度正弦调制的结构化照明在频域以空间混频的方式将样品高频信息编码至光学系统的探测通带内,从而实现突破阿贝衍射极限的约 100 nm 横向分辨率的超分辨光学显微成像[2]。相比于 PALM、STED 等,SIM 具有宽视场、快速成像、光漂白和光毒性弱以及对荧光染料的非特异性需求等独特优势,因此特别适合于活细胞的长期动态超分辨成像[6-8]。尽管有着诸多优势,SIM 仍然受到一些技术上的挑战,其高质量超分辨图像的数值重建很大程度上依赖于对照明参数的精确估计,这些参数的微小误差会对重建结果产生重大影响,导致干扰定量的重建伪影[9,10]。此外,“变化多端”的照明参数对实验环境极为敏感,除非严格保持成像条件稳定,否则需要在每帧超分辨图像重建前从获取的原始观测数据中进行逐帧的照明参数提取[11,12]。目前最广泛使用的基于迭代互相关(iterative cross-correlation method, COR)的参数估计法通过实空间相位梯度形式的亚像素优化提取高精度的照明参数(波矢、初相位、调制度)[13]。然而,COR 的性能受到维持活细胞长期成像所需的低光漂白和光毒性的严苛成像条件所导致的低信噪比的影响,且复杂耗时的迭代优化过程大大降低了 SIM 的图像重建效率,对快速、实时、长时程、无伪影的活细胞动态超分辨成像构成了严峻挑战。
基于主成分分析的结构光照明显微技术
近日,来自南京理工大学的陈钱、左超教授课题组开发了一种高效、鲁棒的基于主成分分析的结构光照明显微技术(PCA-SIM),首次实现了在有外界干扰的复杂、低信噪比实验环境下对照明参数的快速自适应精准补偿和对活细胞精细结构的实时、高质量动态超分辨成像。该研究成果以“Structured illumination microscopy based on principal component analysis”为题发表于卓越计划高起点新刊 eLight。文章第一作者是南京理工大学博士生钱佳铭,通讯作者是南京理工大学左超、陈钱教授,南京理工大学为论文唯一单位。
文章创新地提出了结构光照明模型的相量(Phasor)分析法。研究人员发现,理想无干扰条件下的结构光照明相量矩阵应是一个秩-1 矩阵。换句话说,理想的相量矩阵只包括一个“主成分”,其在最小二乘意义上描述了相量矩阵仅处于一个单一维度的“特征子空间”。然而,由于噪声、光学像差、样品非均匀调制度等干扰因素,通常情况下实验上所获得的相量矩阵将会存在不规则的高维分量。如何消除这些高维干扰分量,获得对应理想照明相量矩阵中单一“主成分”,将是低信噪比条件下进行 SIM 准确参数估计的关键。
主成分分析(Principal Component Analysis,PCA)是最重要的数据降维方法之一,其利用正交变换把由线性相关变量表示的原始数据转换到少数几个由线性无关变量表示的低维度子空间上,称为主成分。这恰恰与前面所述的从相量矩阵中准确估计照明参数所要完成的任务不谋而合。因此,研究人员利用 PCA 的“降维”特性,将实验采集到的照明相量矩阵中的干扰成分剔除,以提取由照明参数主导的“第一主成分”,从根本上消除了影响照明参数精确估计的干扰项,从而以简单高效的方式精准识别亚像素精度的波矢量与初相位(图 2d)。研究人员进一步发现,理想照明相量矩阵的离散傅里叶逆变换本质上是一个中心能量集中的狄利克雷(Dirichlet)函数。这种信号的高度局域化启发研究人员在频谱域中引入了双窗掩膜算子,从而在进一步抑制噪声干扰的同时,将 PCA 的运算量减少约两到三个量级,极大改善了照明参数估计的计算效率、准确性和稳定性。高精度、非迭代重建、鲁棒的抗噪性和较低的运算量使 PCA-SIM 为快速、长时程、无伪影的活细胞超分辨成像开辟了一条新途径。

图2:基于主成分分析的结构光照明显微技术流程图。a 原始 SIM 图像及分离的三个频谱成分。b 被整像素频移的 1 级频谱。c 对图b逆傅里叶变换所得频谱的相位图(c1),图 c1 中蓝色方框区域的相位图(c2),图 c2 的理想形式(c3),图 c3 的绝对相位(归一化为-π到π,c4)。亚像素波矢表现为理想相位的斜率,但其湮没于各种干扰导致的严重噪声中。d 从顶部至底部依次为:原始相位,使用掩蔽算子后的相位,使用 PCA 后的相位,最小二乘法拟合后的相位。使用掩膜算子和 PCA 后,原始相位中的不相关成分被有效地去除,“净化”后的相位分布接近于理想形式。e 从底部至顶部依次为:获取的亚像素精度的波矢及合成的超分辨频谱
通过数值仿真验证 PCA-SIM 在精度、效率和抗噪性方面的综合性能
研究人员通过一系列对 BPAE(bovine pulmonary artery endothelial)细胞的数值仿真验证了 PCA-SIM 的有效性(图3)。不同信噪比下的定量数据和定性结果表明,PCA-SIM 在常规信噪比下(0~30 dBW 高斯噪声)实现了约 0.01 像素精度的波矢估计和2π‰弧度精度的初相位估计;在较低信噪比下(30 dBW~40 dBW),COR 的参数估计误差逐渐增大并产生轻微的重建失真,而 PCA-SIM 依旧保持高的参数估计精度与图像重建质量;在极低信噪比下(>40 dBW),PCA-SIM 凭借出色的抗噪性仍能重建出相对高质量的超分辨图像,而其他方法均产生了较为严重的伪影。就速度而言,非迭代的特性使得 PCA-SIM 的处理速度快于 COR 近 20 倍。仿真结果表明,PCA-SIM 在精度、效率和鲁棒性方面具有最佳综合性能。
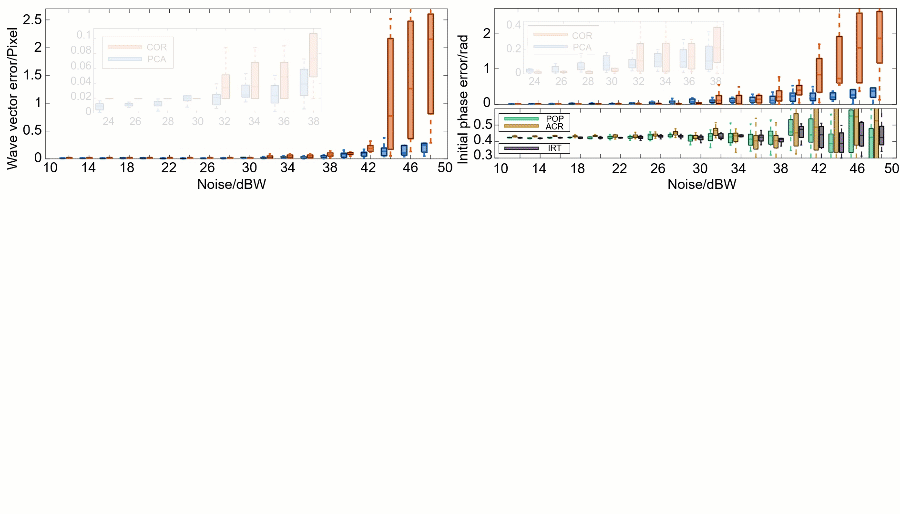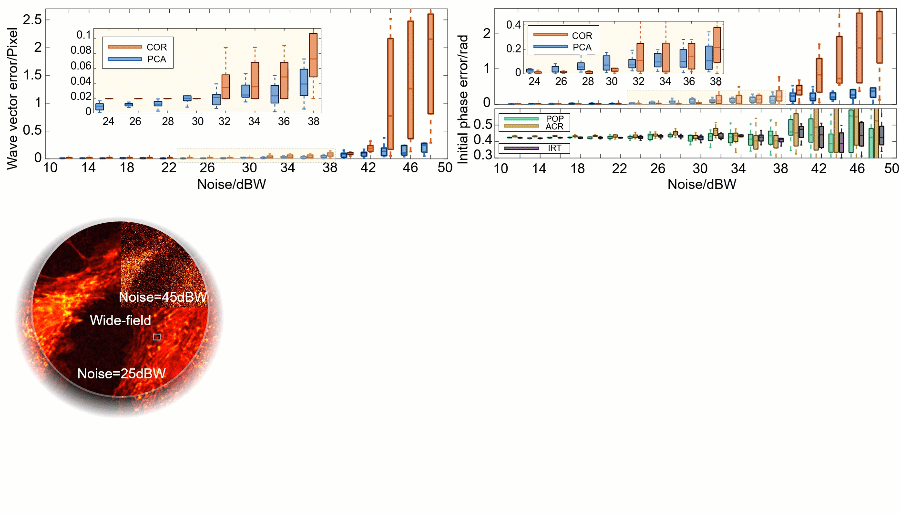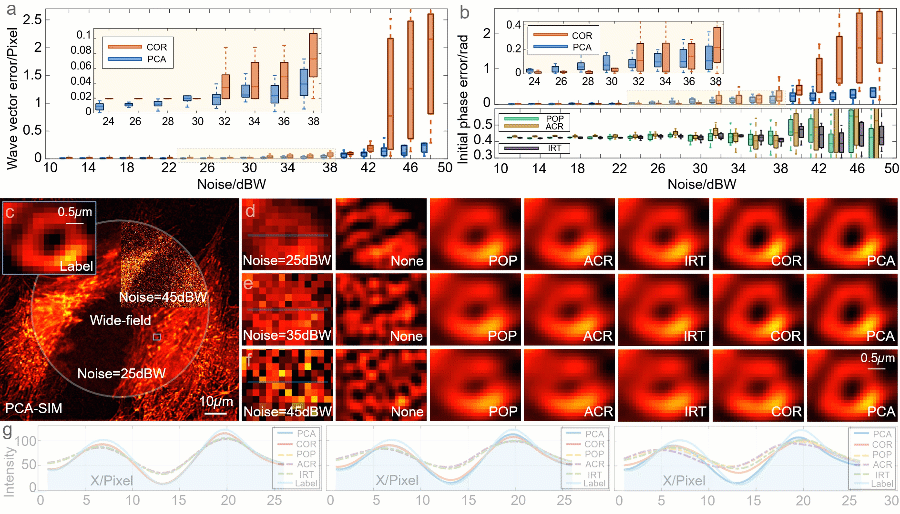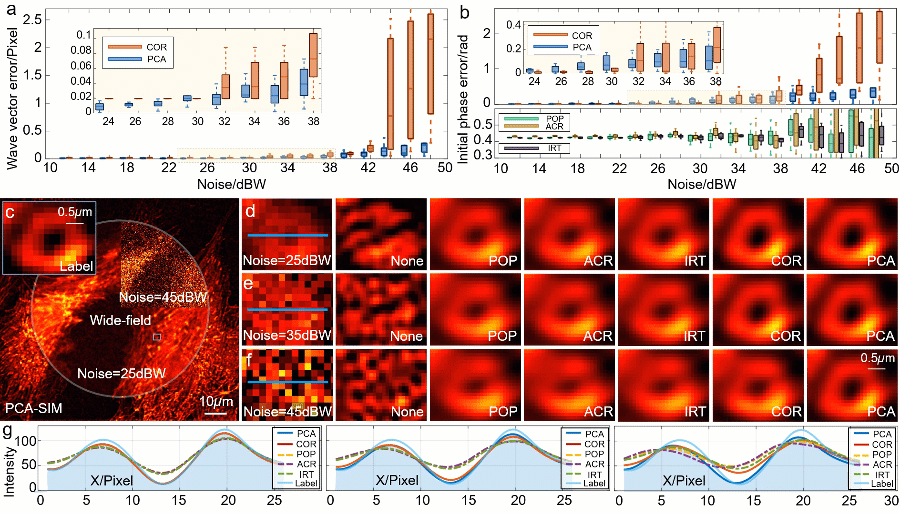
图3:不同 SIM 参数估计和图像重建方法在不同信噪比下的模拟实验。a 不同的信噪比下 PCA-SIM 和 COR 的波矢误差。b 不同方法(PCA-SIM、COR、POP、ACR 和 IRT)在不同的信噪比下的初始相位误差。c 不同信噪比下样品宽场图像和由 PCA-SIM 重建的超分辨图像。d-f 图c中方框区域的宽场图像(左)和通过不同方法获得的超分辨图像(“None”表示没有参数估计)。g 沿图d-f 中浅蓝线的强度分布曲线。该数值仿真独立重复十次。注:“POP”表示峰值相位法[11](phase-of-peak,POP),“ACR”表示非迭代自相关法[12](non-iterative auto-correlation reconstruction,ACR),“IRT”表示图像重组变换法[14](image recombination transform,IRT),三种方法皆为基于整像素波矢精度的快速参数估计法
通过对比实验证明 PCA-SIM 在超分辨成像质量和抗噪性方面的综合性能
研究人员搭建了一套三色干涉式 SIM 超分辨仪器(图4)进一步验证 PCA-SIM 的先进性。图 5 给出了常规信噪比下通过不同方法对固定 COS-7(CV-1 in Origin Simian-7)细胞样片的超分辨重建结果。相比于基于整像素波矢精度的参数估计法(POP、ACR 与 IRT),PCA-SIM 和 COR 以更高的保真度和对比度重建出 COS-7 细胞线粒体与肌动蛋白的精细结构。对超分辨图像荧光强度分布的进一步分析表明 PCA-SIM 较 COR 具有更高的成像分辨率(图 5d)。此外,研究人员通过一组对固定 HeLa 细胞样片的对比实验验证了 PCA-SIM 具有出色的抗噪性。随着信噪比的降低,由 COR 获取的超分辨图像中出现了明显的结构失真和对比度不均衡的现象(图 6a-6e)。相比之下,PCA-SIM 有效地抑制了这些图像伪影并重建出与常规信噪比下相当的高质量超分辨结果。不同信噪比下的定量化数据表明,PCA-SIM 在强噪声条件下仍具有较强的鲁棒性(图 6f),展现出其在低曝光条件下对活细胞动态、长时程成像的潜力。

图4:研究人员搭建的三色干涉式结构光照明显微仪器示意图。激发光通过一系列二向色镜与反射镜由空间滤波器扩束准直,照射在显示高频光栅图像的空间光调制器上并发生衍射,±1 级衍射光通过显微物镜在样品表面发生干涉,激发出的荧光通过物镜与二向色镜被相机接收。M1-M4:平面镜;DM1-DM2:二向色镜;L1-L4:消色差透镜;H1-H2:半波片;PBS:偏振分束器;SLM:空间光调制器;FM:荧光滤光块;OBJ:物镜;TL:筒镜;PR:偏振旋转器
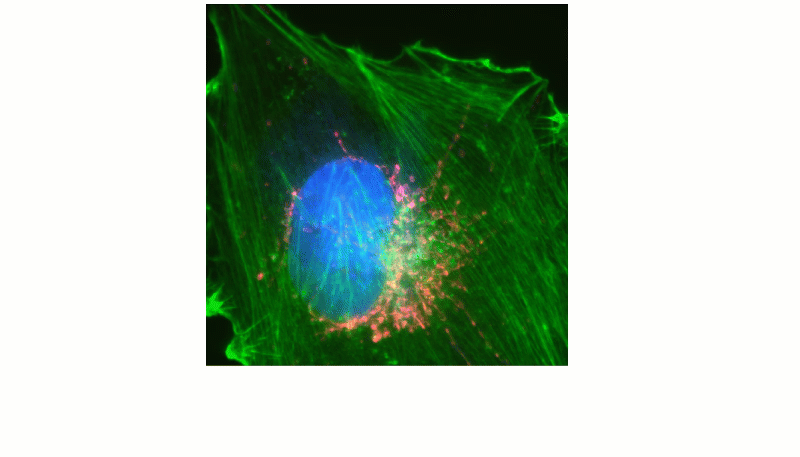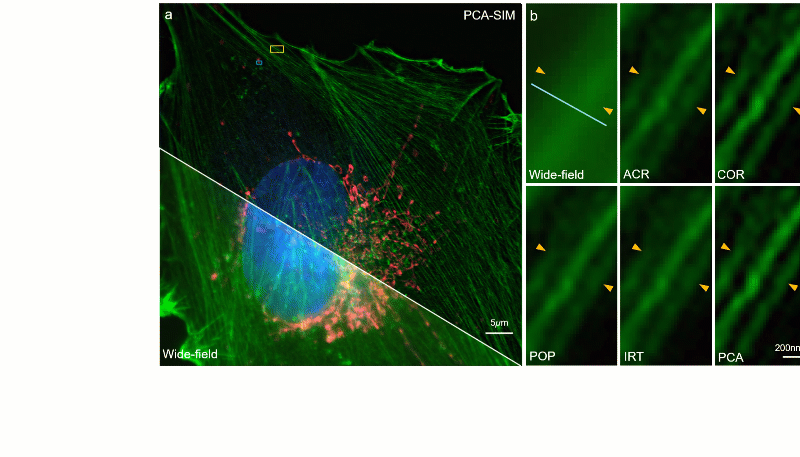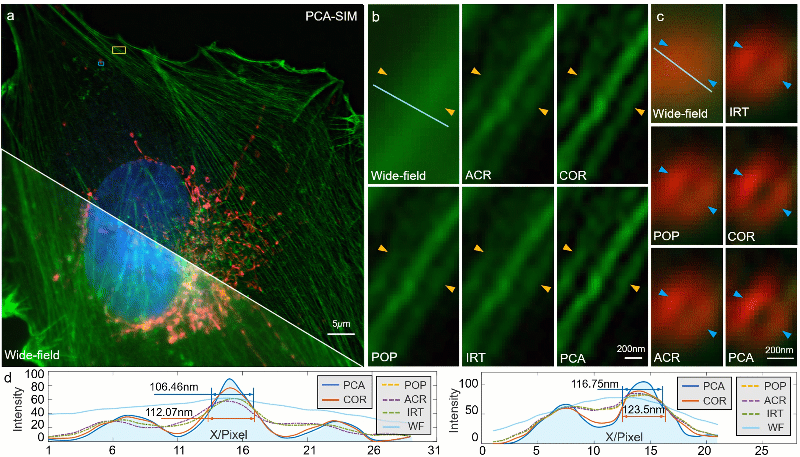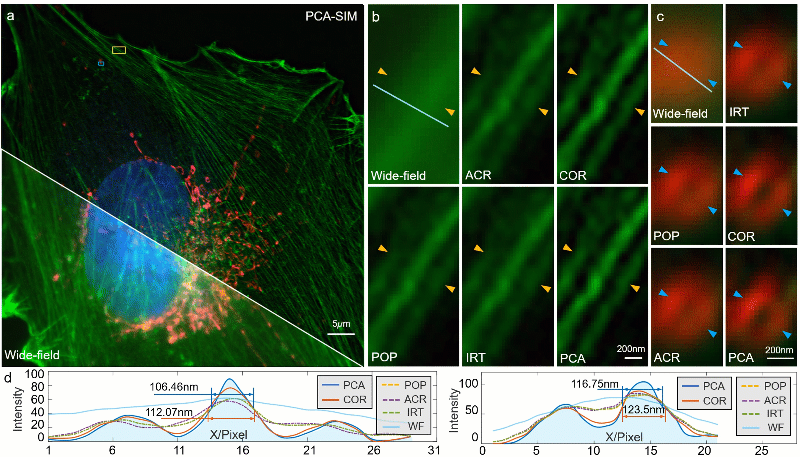
图5:常规信噪比下对 COS-7 细胞的实验结果。其中细胞核、肌动蛋白、线粒体分别由 DAPI、Alexa FluorTM 568 与 MitoTrackerTM Green FM 进行标记。a 宽场图像与 PCA-SIM 获取的超分辨图像。原始图像通过 100X 1.40NA 物镜(UPlanSApo 100X 1.40 Oil)获取。为便于区分,COS-7 细胞的线粒体、肌动蛋白和细胞核分别用红色、绿色和蓝色表示,并分别由 488nm、405nm 及 561nm 激光所激发。b 通过不同方法获得的图a黄色方框区域内的肌动蛋白的超分辨图像。c 通过不同方法获得的图a蓝色方框区域内的线粒体的超分辨图像。d 沿图b-c 中白线的强度分布曲线
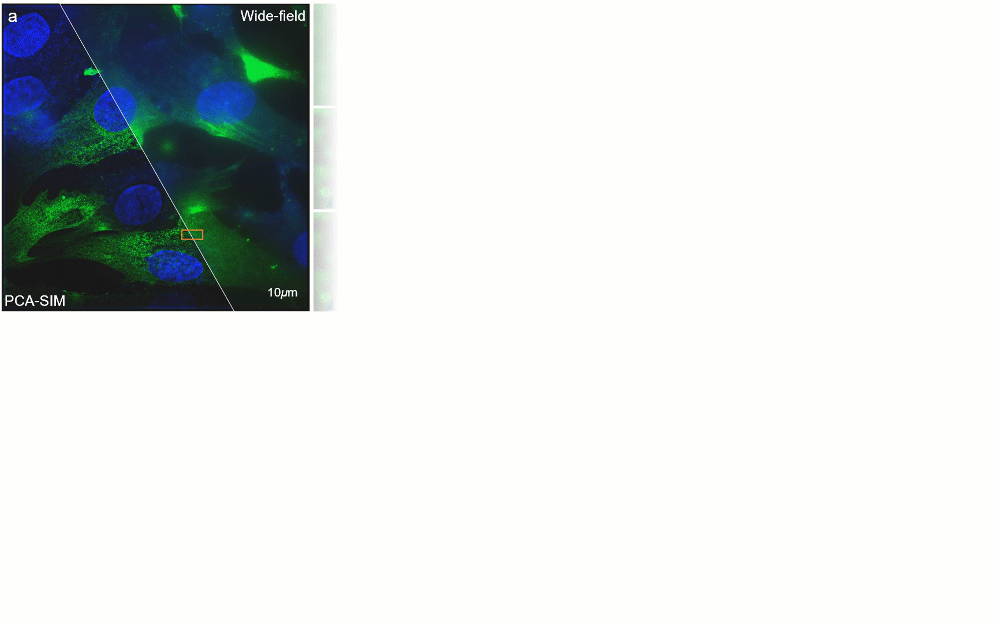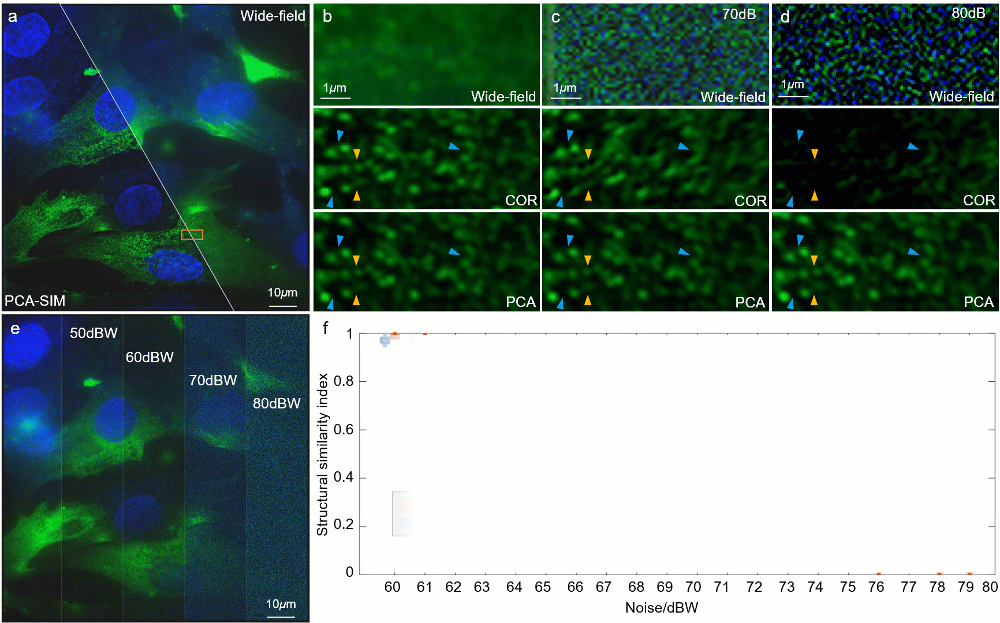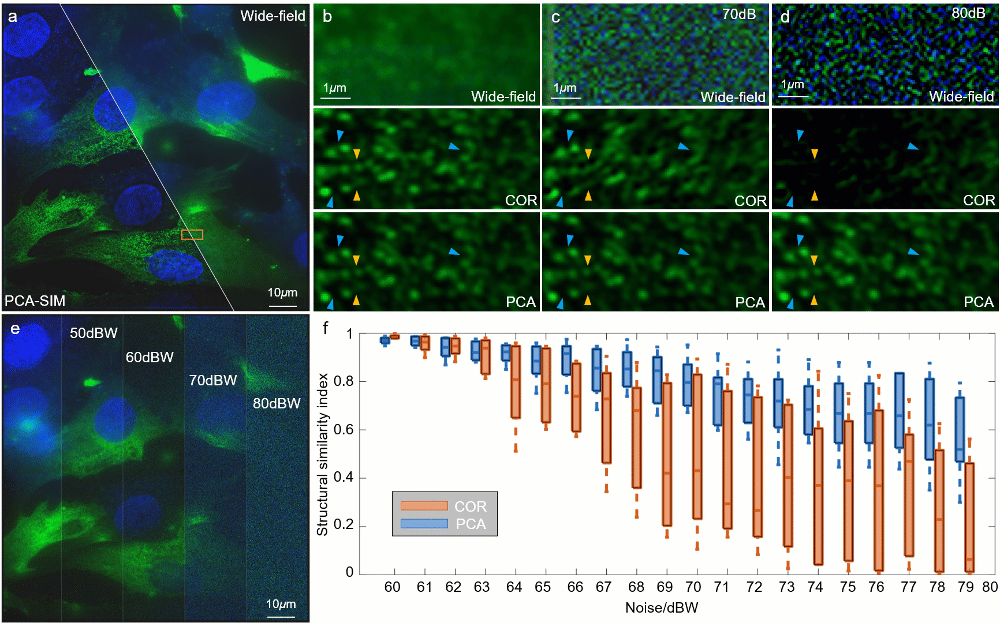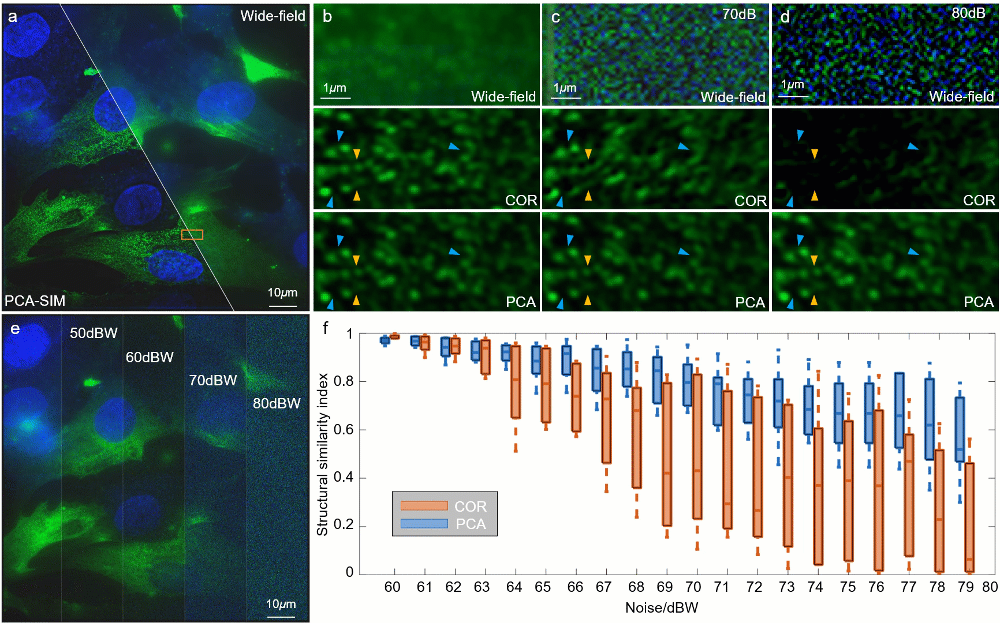
图6:不同信噪比下对 HeLa 细胞的实验结果。其中细胞核与α肌动蛋白分别由 DAPI 与 FITC 标记。a 宽场图像和通过 PCA-SIM 获取的超分辨图像。原始图像通过 60X 1.42NA 物镜(UPlanXApo 60X 1.42 Oil)获取。HeLa 细胞的α肌动蛋白和细胞核分别用绿色和蓝色显示,并分别由 488nm 和 405nm 激光所激发。b-d 不同信噪比下的图a中方框区域的宽场图像与通过 COR 和 PCA-SIM 获得的超分辨图像。e 不同信噪比下的宽场图像。f COR 和 PCA-SIM 在不同信噪比下的超分辨率结果相对于图b中结果的结构相似性指数(structural similarity index measure,SSIM)。该实验独立重复 30 次
照明参数自适应补偿的活细胞实时超分辨成像
PCA-SIM 的一个重要应用是在复杂或恶劣的操作环境下实时地观测亚细胞结构的动态过程。为了验证这一点,研究人员利用计算机图形处理单元(graphics processing unit,GPU)实现了基于 PCA-SIM 的约 11 帧每秒的实时超分辨图像重建与显示,并实时观测了活体 COS-7 细胞的线粒体动态小管事件(mitochondrial dynamic tubulation,MDT)。如图 7a-7b,从线粒体中迅速延伸的细长且高度动态的 MDT 小管与其他线粒体发生融合并形成它们之前的膜桥,期间发生了某些物质的转移(图 7b 白色虚线圈所标记区域),随后 MDT 小管逐渐增厚并趋于稳定,最终构成线粒体网络。这些实验现象对研究线粒体网络的形成以及线粒体功能(如线粒体 DNA 完整性、细胞凋亡等)的维持具有重要意义。视频 1 提供了完整的动态超分辨重建结果,尽管显微镜操作者频繁地调整感兴趣区域与成像焦距,并伴有一些由人为因素导致的环境扰动,PCA-SIM 凭借高效、鲁棒的自适应参数估计能力始终保持着较高的超分辨重建质量。
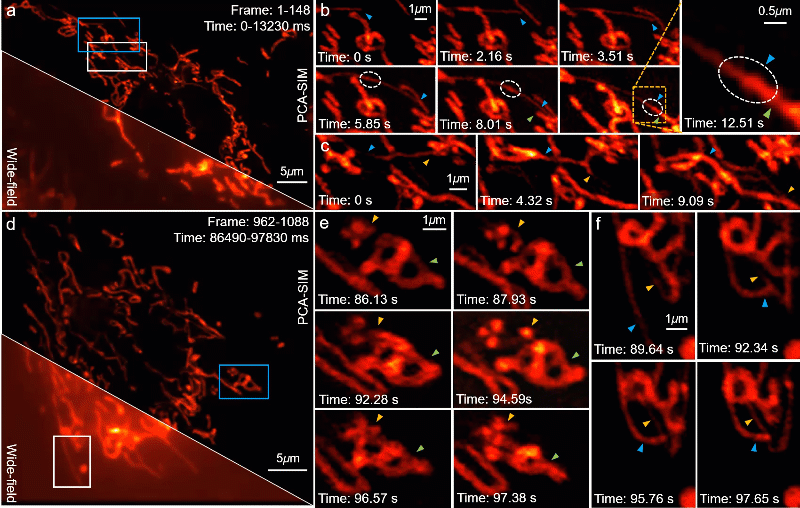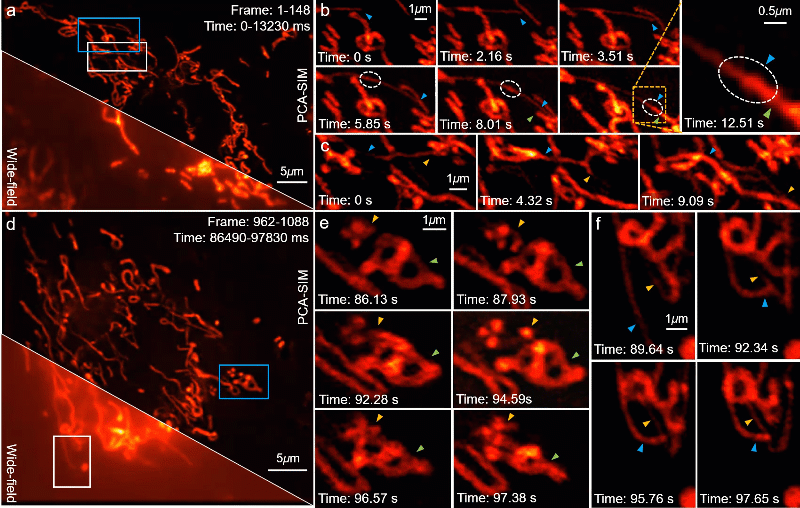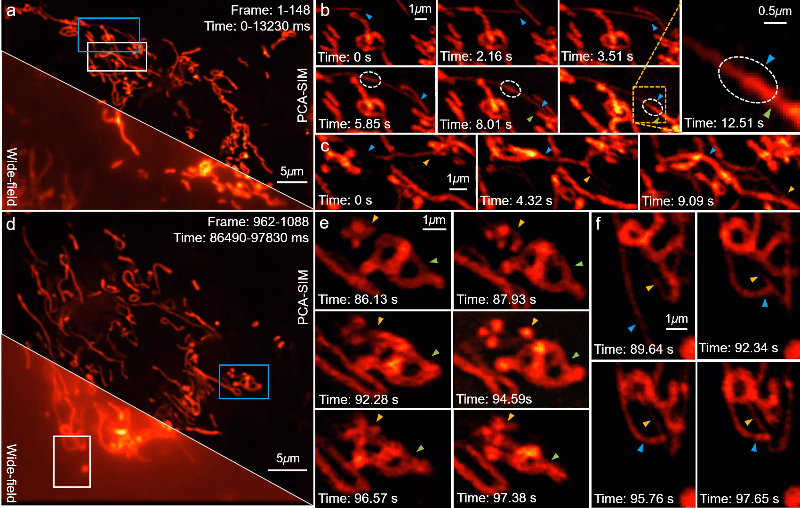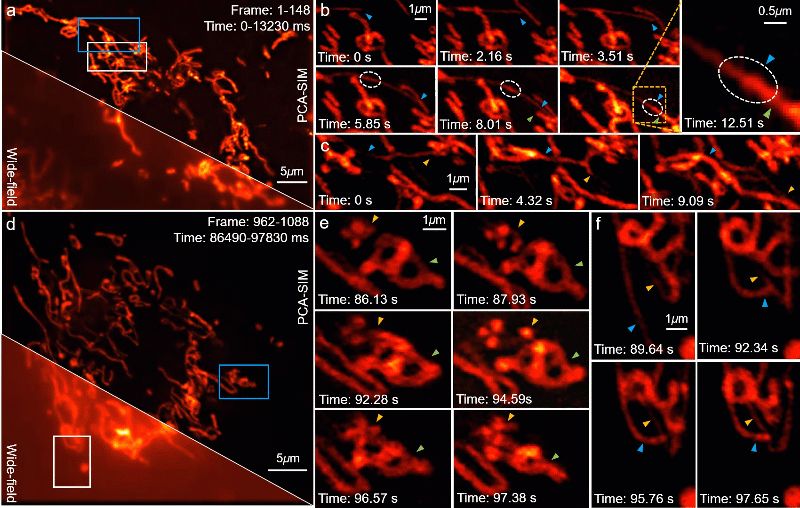
图7:在不同时间点对 COS-7 细胞线粒体的实时超分辨重建结果。其中线粒体通过 MitoTrackerTM Green FM 标记。a, d 宽场图像和 PCA-SIM 获得的超分辨图像。原始图像通过原始图像通过 60X 1.42NA 物镜(UPlanXApo 60X 1.42 Oil)获取。b, c 图a中蓝色方框内区域在不同时间点的超分辨图像。e, f 图d中蓝色和白色方框内区域在不同时间点的超分辨图像
PCA-SIM 为研究活细胞中纳米尺度结构演化、细胞器互作和生物分子动力学信息提供了一种快速实时、方便鲁棒、低光损伤的成像新手段,在生命科学、基础医学等领域具有广阔的应用前景。
附注:本文提供了 PCA-SIM 算法和相关数据的【开源 MATLAB 工具箱】及【详细用户指南】(Additional file 4),以方便读者理解算法原理并复现实验结果,请阅读论文原文及相关补充材料以获取有关本文更多的详细内容。(来源:中国光学微信公众号)
相关论文信息:https://doi.org/10.1186/s43593-022-00035-x
参考文献
封面图来源:
1. Westphal, V. et al. Video-rate far-field optical nanoscopy dissects synaptic vesicle movement. Science 320, 246–249 (2008).
2. Gustafsson, M. G. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198, 82–87 (2000).
3. Betzig, E. et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science 313, 1642–1645 (2006).
4. Rust, M. J., Bates, M. & Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat. Methods 3, 793–796 (2006).
5. Weiss, P. S. Nobel prizes for super-resolution imaging. (2014).
6. Li, D. et al. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science 349, (2015).
7. Markwirth, A. et al. Video-rate multi-color structured illumination microscopy with simultaneous real-time reconstruction. Nat. Commun. 10, 1–11 (2019).
8. Wang, Z. et al. High-speed image reconstruction for optically sectioned, super-resolution structured illumination microscopy. Adv. Photonics 4, 026003 (2022).
9. Müller, M., Mönkemöller, V., Hennig, S., Hübner, W. & Huser, T. Open-source image reconstruction of super-resolution structured illumination microscopy data in ImageJ. Nat. Commun. 7, 1–6 (2016).
10. Huang, X. et al. Fast, long-term, super-resolution imaging with Hessian structured illumination microscopy. Nat. Biotechnol. 36, 451–459 (2018).
11. Shroff, S. A., Fienup, J. R. & Williams, D. R. Phase-shift estimation in sinusoidally illuminated images for lateral superresolution. J. Opt. Soc. Am. A 26, 413 (2009).
12. Wicker, K. Non-iterative determination of pattern phase in structured illumination microscopy using auto-correlations in Fourier space. Opt. Express 21, 24692 (2013).
13. Gustafsson, M. G. L. et al.Three-Dimensional Resolution Doubling in Wide-Field Fluorescence Microscopy by Structured Illumination. Biophys. J. 94, 4957–4970 (2008).
14. Zhou, X. et al. Image recombination transform algorithm for superresolution structured illumination microscopy. J. Biomed. Opt. 21, 096009 (2016).






