
从本质上来说,一切的生命活动都基于正确、有序的蛋白质水平活动。原则上只要有正确的 mRNA 序列,细胞就能对应合成出任何蛋白质来调整或指导正确的生命活动,从而改善或治疗各类疾病。
由于在核苷碱基修饰方面的贡献和奠定的基础,使 mRNA 疫苗得以有效地抗击新冠疫情,2023 年的诺贝尔生理学或医学奖授予卡塔林·卡里科(Katalin Karikó)和德鲁·魏斯曼(Drew Weissman)。
目前全球广泛使用的 mRNA 疫苗属于纳米技术的一种,本质上是通过脂质纳米颗粒递送 mRNA、在体内翻译表达出新冠病毒蛋白片段,并诱导人体免疫反应产生抗体来对抗新冠病毒感染。
需要了解的是,mRNA 自身并不能够主动进入细胞表达特定的目标蛋白,所以 mRNA 技术在实际的应用中,离不开递送系统的帮助。因此,mRNA 修饰合成(包括化学修饰、序列优化和生产纯化等)和纳米递送两方面技术必须是“两条腿同时走路”。

图丨陶伟(来源:Harvard Catalyst)
陶伟博士是美国哈佛大学附属布莱根妇女医院 Farokhzad Family 创新杰出讲席教授(Endowed Chair)、哈佛大学医学院助理教授,也是所在单位历史上第一位以助理教授身份获得杰出讲席教授头衔的华人学者。
他也是美国肺脏协会 Courtney Cox Cole 研究员、《麻省理工科技评论》中国“35 岁以下科技创新 35 人”2020 年入选者之一,连续入选科睿唯安“全球高被引学者”、全球前 2% 顶尖科学家(终身影响力榜单)。
此外,他还担任细胞出版社 Matter 期刊的顾问编委、Materials Today 期刊的高级编委等。
陶伟教授课题组的主要研究方向包括纳米技术、生物材料和药物递送技术的研发及其广泛的生物医学应用。基于近年来取得的一系列原创成果,不仅覆盖 mRNA 治疗技术,还应用在包括癌症、心血管疾病、糖尿病和消化道疾病、病毒、细菌感染等在内的广泛领域。

开发首个粘性 mRNA 纳米颗粒,实现 mRNA 药物在粘膜器官内局部递送
膀胱具有独特的结构和生理屏障,通过静脉注射的系统性递送等传统方式很难将药物递送至膀胱部位。
为延长治疗性药物在膀胱中的停留时间,提高对膀胱癌组织的吸收和渗透,迫切需要一种能够粘附在膀胱,并在膀胱癌中持续有效地递送 mRNA 的药物递送策略。
该团队研发了首个粘性 mRNA 纳米颗粒,不仅能在粘膜器官内局部递送 mRNA 药物,还可以使目标蛋白特异性地局部表达,有望用于粘膜器官的疾病机理研究或治疗研究,相关论文在 PNAS 以封面论文形式发表[1]。

图丨相关论文(来源:PNAS)
具体而言,研究人员报道了一种基于粘性纳米颗粒的 mRNA 递送策略,用于在 Kdm6a 抑癌基因缺失的原位膀胱癌小鼠模型中,膀胱灌注递送 KDM6A-mRNA。
这种黏性的 mRNA 递送系统能稳定地黏附在膀胱内壁表面,而不会被尿液冲走,并持续递送增强其渗透能力,使 mRNA 药物在原位膀胱癌中的暴露时间大幅度增加,从而有效表达目标蛋白(KDM6A 抑癌蛋白)产生治疗效果。
值得一提的是,相比起静脉注射的系统性递送策略,基于这种粘性 mRNA 纳米颗粒的局部递送策略由于仅作用于局部、并且局部使用 mRNA 纳米颗粒的剂量要远小于系统递送的剂量,具备更好的生物安全性。
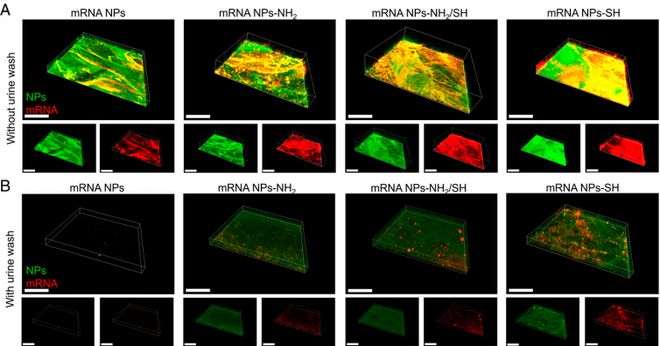
图丨粘膜黏附 mRNA 纳米粒附着在膀胱内壁表面、高效持续递送 mRN
此外,该研究还揭示了 KDM6A 在抑制膀胱癌转移方面的治疗潜力。实际上,在膀胱内实现目标蛋白的高效局部表达,仅是该技术的应用场景之一,它在癌症免疫治疗中也具有应用的可能性。
mRNA 局部递送策略也可以避免由系统性全身递送,和不必要的蛋白表达而引起的潜在毒性问题。陶伟教授表示:“我们预期这种黏附 mRNA 纳米技术,还能够有效地在各类其他粘膜器官内原位上调各类目标蛋白,从而了解更多疾病的机制和进行治疗研究。”
现阶段,利用纳米颗粒递送 mRNA 进行肿瘤治疗方面(包括肿瘤疫苗等),已有很多研究在进行不同阶段的临床试验[12]。
陶伟教授团队也在 Nature Reviews Cancer 上,对 mRNA 癌症治疗领域的现状进行了梳理和总结、并对领域未来发展提出了前瞻性观点(该论文也是 2023 年度 Nature Reviews Cancer 期刊上下载量前三位的论文)。

图丨相关论文(来源:Nature Reviews Cancer)
近期,陶伟教授课题组还在 PNAS 报道了另一种双靶向的 mRNA 纳米颗粒递送系统,这些可吸入性的 mRNA 纳米颗粒能够同时靶向肺部的巨噬细胞和肿瘤细胞,实现目标蛋白在肺部这两种细胞中的高效表达[3]。

图丨相关论文(来源:PNAS)
陶伟教授表示,考虑到肿瘤细胞或巨噬细胞在各类肺部疾病中至关重要性的作用,该研究有望为开发针对肺癌、肺部感染或肺部炎症等肺部疾病的新型吸入性 mRNA 疗法或吸入性 mRNA 疫苗奠定基础。
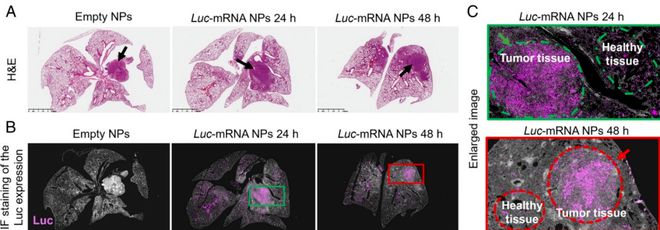
图丨吸入性双靶向 mRNA 纳米粒在肺部主动靶向肿瘤组织、高效表达
此外,该研究也为解决 mRNA 的器官靶向递送和细胞靶向递送方面的挑战(尤其是针对肺部的特定细胞类型),提供范式参考和研究基础。

基于外部“刺激-响应”策略,实现仅在肿瘤部位超声治疗的纳米疗法
声动力治疗(sonodynamic therapy ,SDT)是一种诱导肿瘤细胞死亡的治疗方法,声敏剂进入细胞后,当受到超声波激活时,它们会产生活性氧物质。
活性氧的生成效率尤为重要,而衡量纳米声敏剂活性氧生成效率的关键指标之一是能带间隙。更低的能带间隙,可以让纳米材料在超声波能量的激发下更快地产生活性氧。
一些其他已知的纳米声敏剂由于较宽的能带间隙(分别为 3.2eV 和 3.1eV),声动力疗法的性能相对有限,例如二氧化钛(TiO2)和氧化锌(ZnO)等。
陶伟教授课题组开发了一种具有窄能带间隙(Eg=1.18eV)的硫化亚锡(SnS)纳米颗粒,并用它制备声敏剂提高声动力疗法的性能,相关论文发表在Nature Communications上[4]。

图丨相关论文(来源:Nature Communications)
值得关注的是,该研究所采用的 SDT 基于纳米颗粒在超声波刺激下,产生活性氧对肿瘤细胞进行杀伤,并不会针对特定的肿瘤细胞,而是普适性地适用于杀伤任何类型的肿瘤细胞。
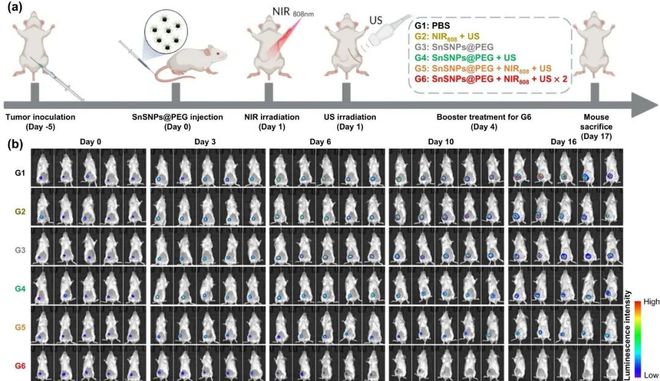
图丨硫化亚锡纳米颗粒介导的 SDT 的抗肿瘤功效(来源:Nature Co
此外,由于这种策略基于超声响应的外部“刺激-响应”策略(杀伤作用只在超声部位产生),因此能够实现仅在肿瘤部位进行超声治疗(配合成像诊断技术),从而减少毒副作用和对正常组织的损害,实现只在肿瘤部位的特异性治疗。
在另一项通过“刺激-响应”策略进行肿瘤特异性治疗的研究中,他们还通过近红外光的刺激制备的纳米药物,仅在肿瘤部位产生光热效应和光动力学效应,从而实现特异性肿瘤消融作用,相关研究也发表在 Nature Communications 上[5]。
陶伟教授课题组还在细胞出版社 Med 期刊上的受邀论文中,对已通过临床审批的 14 项应用于肿瘤治疗的纳米药物进行罗列和分类介绍[2]。目前,在全球范围内已有多个国家批准纳米药物应用于癌症治疗,包肿瘤的化疗、放疗、热疗等方向的应用。

利用纳米技术、生物材料和药物递送技术为医疗领域提供更多新策略
除了在癌症领域的应用,陶伟教授带领的团队所开发的技术还应用在心血管疾病、糖尿病和消化道疾病等领域。
在心血管疾病应用方面,研究人员设计了首个能够靶向动脉粥样硬化斑块中巨噬细胞的 CaMKIIγ 基因的 siRNA 纳米颗粒,能够有效敲除动脉粥样硬化中至关重要的疾病基因、有效抑制动脉粥样硬化的进展,相关论文发表在Nature Protocols上[6]。
陶伟教授表示,这项研究有望为纳米颗粒介导的其他类型 RNA 分子递送到病变巨噬细胞的应用提供启发,以探索和验证动脉粥样硬化治疗的新靶点和途径。

图丨相关论文(来源:Nature Protocols)
为改善糖尿病的慢性并发症,陶伟教授课题组通过开发新型黑磷基水凝胶药物递送系统来解决该问题,相关论文发表在PNAS上[7]。
在喷涂这种新型凝胶后,能够构筑出一道类似人工皮肤的“屏障”,不仅能够起到将糖尿病伤口组织和外部环境短暂隔离的作用,也同时具备存储药物的功能。
并且,利用来源于近红外激光激活的局部热量,能够促进微血管的血液流动,从而实现按需触发释放盐酸利多卡因缓解疼痛,达到光热治疗消除细菌和减少炎症的目的。
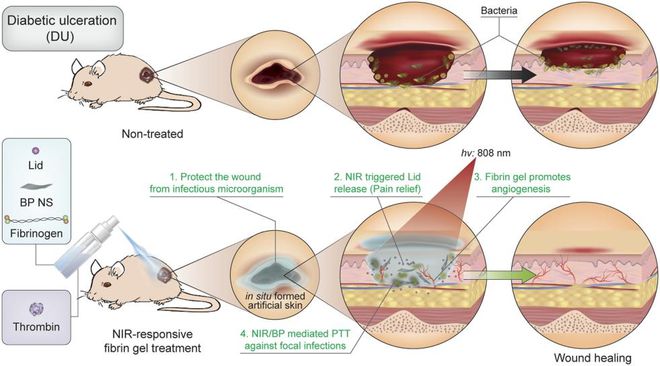
图丨原位喷涂近红外响应止痛凝胶加速糖尿病溃疡伤口愈合的示意图
在消化道疾病应用方面,陶伟教授带领课题组设计了一种基于口服海藻酸钙纳米硒水凝胶微珠的生化策略,相关论文在JACS以封面论文形式发表[8]。口服蛋白类药物递送往往需要解决一系列苛刻的胃肠道难题,而通过该策略可直接在体内原位合成硒蛋白。

图丨相关论文(来源:JACS)
“该研究在一定意义上,极大地改善了治疗性蛋白类药物的口服利用率。为口服蛋白类药物的设计提供了典型的参考范式,同时为综合治疗胃肠道相关疾病等提供了新见解。”陶伟教授表示。

应对全球性的人类健康挑战
抗击新冠疫情离不开基于脂质纳米颗粒递送的 mRNA 疫苗。在新冠疫情期间,陶伟教授团队前瞻性地总结了材料科学和纳米技术在未来应对新冠大流行中的潜在策略,相关论文分别发表在 Nature Reviews Materials 和 Nature Nanotechnology 上[9-10]。
图丨相关论文(来源:Nature Reviews Materials)

图丨相关论文(来源:Nature Nanotechnology)
从原理上来说,mRNA 技术的应用几乎可以涵盖各个疾病领域。在当时,上述研究为各类针对新冠病毒的认识、防护、检测、疫苗和治疗等研究提供了多方面和多维度的思路,也为世界范围内很多实验室彼时正在进行的研究提供了策略和借鉴。
“可以预期的是,不断的创新将带来新的、高效的基于 mRNA 技术的疗法或全新应用,包括针对各类传染性疾病的疫苗、癌症免疫疗法、蛋白替代疗法、基因编辑疗法等。”陶伟教授在他带领课题组发表在Nature Medicine上的前瞻性论文中这样展望[11]。

图丨相关论文(来源:Nature Medicine)
据悉,陶伟教授团队关于 mRNA 技术的论文都被 Nature 编辑部收录在“2023 年诺贝尔生理学或医学奖”专题[11-13]。该课题组也是全球范围内除卡里科博士和魏斯曼博士团队之外,在 Nature 的该诺奖专题被收录论文最多的研究团队。
图丨“2023 年诺贝尔生理学或医学奖”专题论文(来源:Nature)
“作为一个领先的核酸药物递送实验室,我的团队也在开发各类具备自主知识产权的新型 mRNA 递送系统,并期待着开发的这些 mRNA 递送技术能够被转化,以应对更多的、全球性的人类健康挑战。”陶伟教授说道。
参考资料:
1. Kong N., et al. Intravesical delivery of KDM6A-mRNA via mucoadhesive nanoparticles inhibits the metastasis of bladder cancer.PNAS2022, 119(7):e2112696119.
https://doi.org/10.1073/pnas.2112696119
2. Zhang P., et al. Cancer nanomedicine toward clinical translation: Obstacles, opportunities, and future prospects.Med2023, 4(3):147-167.
https://www.cell.com/med/pdf/S2666-6340(22)00517-7.pdf
3. Tang Z., et al. Inhaled mRNA nanoparticles dual-targeting cancer cells and macrophages in the lung for effective transfection.PNAS2023, 120(44):e2304966120.
https://doi.org/10.1073/pnas.2304966120
4. Li Y., et al. Nanosensitizer-mediated augmentation of sonodynamic therapy efficacy and antitumor immunity.Nature Communications2023, 14, 6973.
https://doi.org/10.1038/s41467-023-42509-7
5. Ji X., et al. Capturing functional two-dimensional nanosheets from sandwich-structure vermiculite for cancer theranostics.Nature Communications2021, 12, 1124.
https://doi.org/10.1038/s41467-021-21436-5
6. Huang X., et al. Synthesis of siRNA nanoparticles to silence plaque-destabilizing gene in atherosclerotic lesional macrophages.Nature Protocols2022, 17(3):748-780.
https://doi.org/10.1038/s41596-021-00665-4
7. Ouyang J., et al. In situ sprayed NIR-responsive, analgesic black phosphorus-based gel for diabetic ulcer treatment.PNAS2020, 117(46):28667-28677
https://doi.org/10.1073/pnas.201626811
8. Ouyang J., et al. Oral hydrogel microbeads-mediated in situ synthesis of selenoproteins for regulating intestinal immunity and microbiota.JACS2023, 145(22):12193-12205.
https://doi.org/10.1021/jacs.3c02179
9. Huang X., et al. Nanotechnology-based strategies against SARS-CoV-2 variants.Nature Nanotechnology2022, 17(10):1027-1037.
https://doi.org/10.1038/s41565-022-01174-5
10. Tang Z., et al. A materials-science perspective on tackling COVID-19.Nature Reviews Materials2020, 5(11): 847-860.
https://doi.org/10.1038/s41578-020-00247-y
11. Huang X., et al. The landscape of mRNA nanomedicine.Nature Medicine2022, 28(11):2273–2287.
https://doi.org/10.1038/s41591-022-02061-1
12. Liu C., et al. mRNA-based cancer therapeutics.Nature Reviews Cancer2023, 23(8):526-543.
https://doi.org/10.1038/s41568-023-00586-2
13. Chen S., et al. Nanotechnology-based mRNA vaccines.Nature Reviews MethodsPrimers2023, 3:63.
https://doi.org/10.1038/s43586-023-00246-7
运营/排版:何晨龙






