
文医曜
“登上月球和治愈癌症,你觉得哪个更容易实现?”
在上世纪中期美国媒体的一次民调中,被问到这个问题的美国人给出惊人的一致答案:癌症可能治愈,登上月球是不可能的。
岁月无情地打了他们的脸。时至今日,阿波罗号飞船已经登月几十年,人类却依旧奋斗在治愈癌症的征途中。当然,如今人类对抗癌症的手段越来越多,PD-1、ADC、CAR-T 等技术路线均有突破性的疗效,但却依然距离“治愈”目标很远,科学家们仍然希望继续扩展工具箱,来实现这个夙愿。
单纯从理论角度出发,癌症疫苗可能是最合适的工具:通过利用肿瘤细胞相关抗原,来唤醒人体针对癌症的免疫系统。然而现实却十分残酷,肿瘤疫苗的研究的从未中断过,但却并未有人真正突破。
第一款癌症疫苗因疗效一般、价格昂贵而淡出市场。此后,Celldex 的 Rintega、Argos 的 rocapuldencel-T、和 Agenus 的 Prophage G-200 等多款癌症疫苗也先后在临床试验中以失败告终。
难道癌症疫苗真的只是科学家们的南柯一梦?或许我们并不应该如此悲观,经过长时间的努力,人类已经距离癌症疫苗的成功研发越来越近。
01 癌症疫苗:一上来就是逆风局
疫苗是人类在医学领域里最伟大的发明。每当一款疫苗被研发出来,就意味着某些疾病将被击败,甚至永久性地从人类生活中消失。基于疫苗强大的功效,科学家们开始将疫苗的应用领域逐渐扩大,甚至开始尝试治疗癌症。
最广为人知的预防性癌症疫苗就是当下爆火的 HPV 疫苗。高危型人乳头瘤病毒(HPV)持续感染是导致宫颈癌的主要原因,通过接种 HPV 疫苗可有效预防 HPV 持续感染及相关宫颈病变,是宫颈癌一级预防的主要措施。
不过只有约 15% 的癌症是由病毒引起,更多的癌症则是由于基因突变产生。对于这类癌症,就需要治疗疫苗发挥作用。目前,大多数药企的主攻方向也都是市场更广阔的治疗疫苗。
追根溯源,人类对癌症疫苗的探索,已有百年历史。早在 1893 年,癌症免疫治疗之父 William B. Coley 发现了化脓性链球菌所分泌的丹毒毒素能够引起肉瘤晚期患者的肿瘤消退,奠定了肿瘤疫苗的研究开端。
此后的百年时间中,癌症疫苗发展并不顺利,直至二十一世纪才有所突破。2007 年,治疗前列腺癌的疫苗 Provenge,以 13:4 的压倒性优势获得了 FDA 顾问委员会的支持,站在获批上市的边缘。
但令人意想不到的是,这四张反对票的力量出其不意地强大。反对者表示,Provenge 虽然改善了患者生存率,但肿瘤大小并没有显著变化,疗效乏善可陈,顶多也只是在安全性上大概率治不死患者。
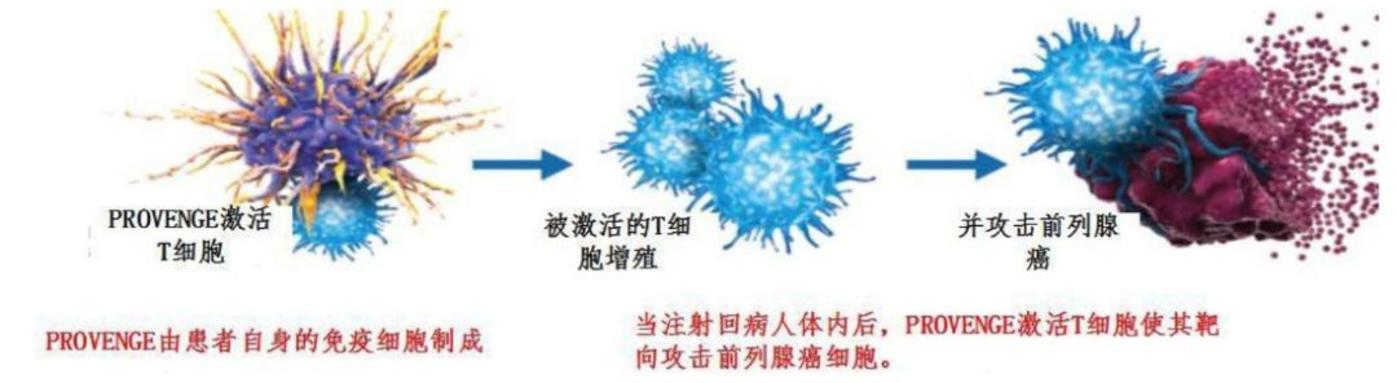
图:Provenge 作用原理,来源:天风证券
这样的说法并不是毫无根据,虽然打着癌症疫苗这个新概念,但 Provenge 的临床数据着实不算亮眼。Provenge 的确没有带来颠覆性的疗效,比起对照组仅仅将患者的总体生存期延长 4.1 个月。
反对者指责投赞成票的人,在癌症药物这档子事上压根一窍不通,才会轻易被这种刺激免疫系统治疗癌症的古老概念诱骗。迫于形势和舆论压力,FDA 只能宣布 Provenge 投票作废,并要求提供更多临床数据支持。当年,《华尔街日报》将此次事件称为癌症免疫疗法史上的“黑色星期三”,癌症疫苗的发展也一夜回到解放前。
经过反复斡旋,Provenge 还是在 2010 年通过了 FDA 的批准,开创了癌症免疫治疗新时代。可事情的发展并没有想象中的顺利,经历重重阻碍成功问世的 Provenge,不仅没给这个领域带来希望反倒是狠狠破了一盆冷水:Provenge 临床效果一般,每疗程定价却高达 9.9 万美元。

图:Provenge 与小分子药物对比,来源:天风证券
作为对照,在 2011 年和 2012 年上市的阿比特龙和恩杂鲁胺,同样治疗疗前列腺癌效果却都比 Provenge 数据更好。在这样的情况下,患者选择用脚投票,最终“跨时代疗法”Provenge 以惨淡销售收场,其背后的研发公司 Dendreon 也落得破产结局。
从那之后,再未有任何一款癌症治疗疫苗成功上市。这么多年过去了,不禁有投资者心生疑问,阻碍癌症疫苗发展的绊脚石究竟是什么呢?
02 问题的七寸究竟在哪里?
癌症疫苗的原理不算复杂。正常情况下,免疫系统会发现并杀死人体的入侵者。但是癌细胞异常狡猾,它并不属于入侵者,而且可以伪装成良民,逃过免疫细胞的火眼金睛。
从机制上看,癌症疫苗的总体思路是让一个人的免疫系统可以精准区分肿瘤细胞和正常细胞,通过将肿瘤抗原以核酸、蛋白多肽等形式导入患者体内,来刺激患者体内自身免疫系统的反应从而对肿瘤细胞进行清除。
一剂癌症疫苗,由肿瘤抗原、制剂、免疫佐剂和运载工具四部分组成。不同癌症患者的肿瘤细胞突变不同,所以癌症疫苗需对个体的肿瘤细胞进行基因测序以识别靶标,进行个性化定制。
靶标通常是肿瘤细胞中出现的突变蛋白,也就是肿瘤抗原,这是癌症疫苗研发过程中的第一个难点。
肿瘤抗原被注射到患者体内后,会激活机体免疫系统杀灭肿瘤细胞的特异性免疫反应。理想的情况下,癌症疫苗所选用的抗原应该存在于所有癌细胞中,并且是癌细胞存活所必需的,但在正常细胞中不存在,所以能更有效地激发人体的免疫反应。
但想要找到完美的肿瘤抗原并不容易。因为肿瘤相关抗原是一种自身抗原,患者对这些抗原可能已经有中枢耐受,这导致免疫系统难以对其产生强烈的免疫反应。并且,肿瘤相关抗原在正常细胞中也有存在,这就导致在免疫系统受到刺激后,正常细胞可能也会被误伤。
可以说,这类被称为肿瘤相关抗原(TAA)的蛋白并非理想抗原。也是因此,据此研发的大部分肿瘤疫苗,不仅达不到理想的治疗效果,还会出现较大的不良反应。
同时,肿瘤微环境也是影响因素之一。免疫抑制细胞的存在,让肿瘤微环境具备免疫抑制效果,保护肿瘤免受免疫攻击,影响癌症疫苗的效果。想提高疫苗的治疗效果,就得想效应免疫细胞克服肿瘤微环境内的多重抑制网络和激活障碍。
此外,适合的体外评估模型、临床研究终点的设计、癌症疫苗的生产等方方面面都充满着未知的挑战。
言而总之,治疗性癌症疫苗想要成功,需要从确定肿瘤抗原、克服免疫抑制肿瘤微环境等角度共同入手。
03 破晓的曙光
陷入技术瓶颈多年后,癌症疫苗终迎破晓曙光:新型肿瘤抗原正在进入科学家视野。
新型抗原通常由肿瘤细胞基因组突变产生,仅存在于肿瘤细胞。由于正常细胞不会产生和表达新抗原,所以能更有效地激发人体的免疫反应。
2021 年的时候,发表在国际顶级《Nature medicine》上的文章披露,NeoVax 新型抗原疫苗用于治疗黑色素瘤患者,可以有效的控制肿瘤生长的免疫反应持续了长达四年。同时,新冠疫情爆发, mRNA 疫苗迅速得到广泛应用,使得 mRNA 在生产策略、递送系统、抗肿瘤免疫策略等多方面取得进展,也加速了癌症疫苗的实际落地速度。
由默沙东与 Moderna 联合开发的皮肤癌疫苗 mRNA-4157,就是根据每位患者肿瘤独特的 DNA 序列突变特征通过算法设计而成,包含编码最多 34 种新抗原的单一合成 mRNA 分子。当将此疫苗注入患者体内时,这些 RNA 所携带的新抗原序列会被翻译成蛋白质,并通过体内的抗原呈递,刺激产生T细胞抗肿瘤反应。
针对肿瘤微环境中的免疫抑制的问题,癌症疫苗与其他免疫疗法的协同,或许会给出解决方案。
比如 mRNA 疫苗与 PD-1 的联用,就是如此。在临床试验中,这一组合已经展示出了潜力。在 ASCO 年会当中,默沙东与 Moderna 公布了 mRNA-4157 与K药联合,在 157 位经手术切除高风险黑色素瘤患者中的疗效与安全性数据。

图:mRNA-4157 联合K药数据,来源:东北证券
与单独使用K药相比,降低肿瘤产生远处转移或死亡的风险达 65%。根据临床 2b 期试验 KEYNOTE-942 的数据,FDA 授予 mRNA-4157 与 Keytruda 组合突破性疗法认定,作为辅助疗法用以治疗完全切除后的高风险黑色素瘤患者。
2023 年底,Moderna 首席执行官接受采访时曾表示,“Moderna 针对黑色素瘤的 mRNA 癌症疫苗可能在两年内上市,这将是抗击这种最严重形式皮肤癌的里程碑式的一步。”看来,经过几十年的缓慢进展,肿瘤疫苗的钟摆终于又荡到了成功的边缘。






