
近日,复旦大学生命科学学院王久存教授、复旦大学人类表型组研究院刘晶青年副研究员与上海市第六人民医院、光华医院团队合作,在 Aging cell 期刊上发表了题为“Single-cell RNA sequencing reveals the CRTAC1+ population actively contributes to the pathogenesis of spinal ligament degeneration by SPP1+ macrophage”的研究论文。研究团队借助单细胞转录组学技术,深入探索了脊柱韧带退变的分子机制,为开发新的治疗方法提供了可能。

研究揭示脊柱韧带退变的关键分子机制,助力新疗法开发
退变性脊柱椎管狭窄(Degenerative Spinal Stenosis, DSS)是老年人常见的致残性疾病,全球数亿人深受其害,且发病年龄趋向年轻化。DSS 不仅限制了患者的日常活动,还给社会经济带来了沉重负担。DSS 发病机制复杂,其韧带骨化过程的分子机制仍不清楚,临床上也缺乏有效的治疗药物。因此,深入探究脊柱韧带退变的分子机制,不仅是科学研究的前沿,更是开发新型治疗方法的迫切需求。
该团队通过对退变韧带中基质类细胞和免疫细胞的基因表达进行深入分析,揭示了致病的关键细胞类型和分子信号通路。研究人员发现,在脊柱狭窄的样本中,韧带附着点的胶原蛋白降解和矿物质沉积显著高于非狭窄外伤样本。通过单细胞测序技术,团队进一步确定了 CTHRC1+ 型成纤维样细胞和 CRTAC1+ 型软骨样细胞,分别为导致胶原蛋白降解和钙化的关键细胞类型。进一步研究发现,髓系免疫细胞在骨化韧带中异常活化,可通过分泌 SPP1 与基质细胞的 CD44 表面蛋白结合,进而激活转录因子 ATF3,发挥其转录活性。在 ATF3 作用下,CRTAC1+ 型软骨样细胞在骨化处大量形成,进而激活 MGP 等骨化分子表达。
该研究揭示了韧带骨化中免疫-基质细胞的互作分子特征,为理解脊柱韧带退变的分子机制提供了新的视角,不仅深化了对 DSS 的认识,还为开发针对该疾病的新型治疗策略奠定了坚实基础。
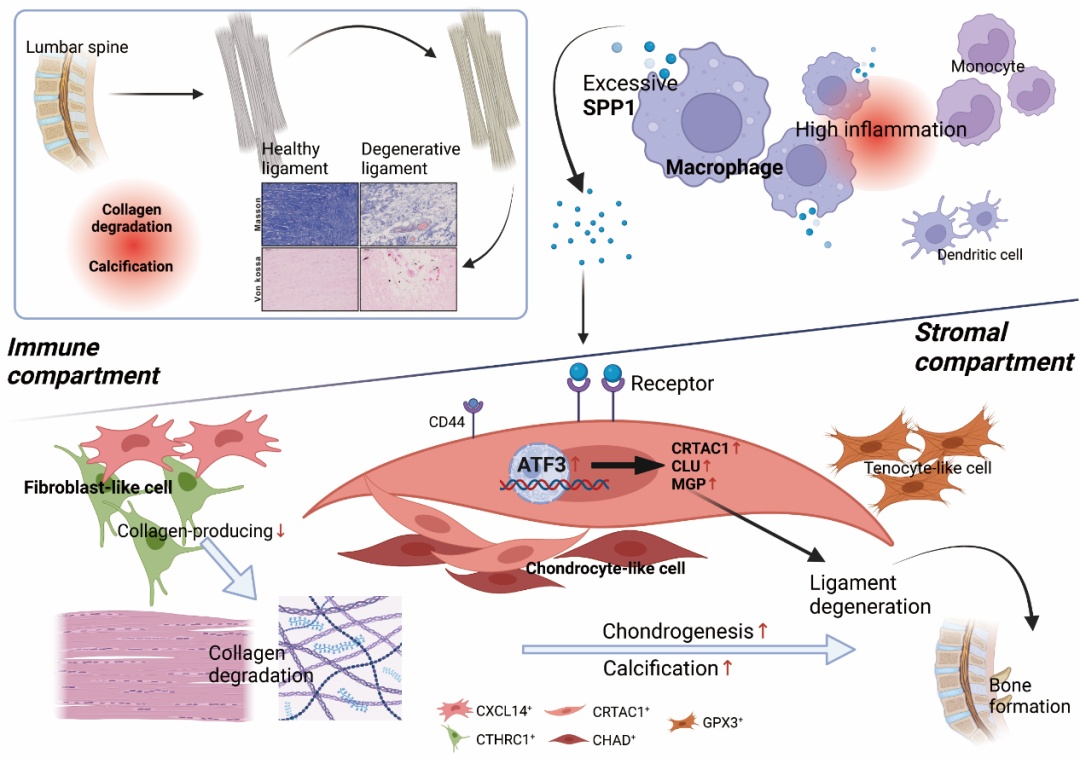
脊柱韧带退变的生物学机制图
复旦大学人类表型组研究院刘晶青年副研究员、生命科学学院王久存教授(华山医院双聘教授)、上海市第六人民医院陈元元主治医师与上海市光华医院朱琦主任医师为论文共同通讯作者。复旦大学人类表型组研究院的博士后唐宇龙、博士研究生卓大春为共同第一作者。本项目获得国家自然科学基金、国际人类表型组计划、中国医学科学院创新基金等项目支持。






